1.薬剤耐性菌について
薬剤耐性菌とは、抗菌薬に耐性を持つ菌のことで、薬剤耐性菌を原因とした感染症に対し、抗菌薬による治療効果が十分に得られないことが懸念されている。近年、抗菌薬の不適切な使用による薬剤耐性菌の増加が指摘されており、国際社会においても大きな課題となっている。抗菌薬は医療分野の他に、畜水産分野においても動物用医薬品や飼料添加物に使用されており、食品を介した薬剤耐性菌のヒトへの伝播の可能性も示唆されている。
こうした中、2015年5月に開催された世界保健機関(WHO)の総会で「薬剤耐性(Antimicrobial Resistance,AMR)に関するグローバル・アクション・プラン」が採択された。これを受けて2016年4月に日本政府は「薬剤耐性(AMR)対策アクションプラン」を公表した。今後、ヒト、動物、食品、環境等に関する薬剤耐性問題について、分野横断的に取組(ワンヘルスアプローチ)を推進していくことが求められる。
当センターでは、食品由来の薬剤耐性菌の検査や調査を実施している。今回、東京都内で流通する食肉から分離されたバンコマイシン耐性腸球菌(Vancomycin Resistant Enterococci,VRE)とβラクタマーゼ産生大腸菌の検出状況について紹介する。
2.バンコマイシン耐性腸球菌(VRE)
VREは病原性が弱く、健常者への危害はほとんどないが、感染防御機能の低下したヒトでは日和見感染症を発症させることがある。本菌による感染症は、感染症法において全数報告対象(五類感染症)であり、感染症発生動向調査事業における2015年の届出数は、東京都で2例、全国では66例であった。
VREはVCM(バンコマイシン)耐性遺伝子の型によりVanA、VanB、VanC型などに分類される。このうち、VanAおよびVanB型はVCMに高度耐性を獲得している。また、耐性遺伝子がプラスミド上にあるため、水平伝播が起こりやすい。食肉中のVREについては、VCMと交差耐性のあるグリコペプチド系抗生物質アボパルシンが過去に飼料添加用成長促進剤として家畜に使用されていたことから、VRE汚染との関連が指摘されている。1990年代半ば以降、世界的にアボパルシンの家畜への使用は禁止されたが、厚生労働省が1996から2000年に行った食肉中のVRE汚染サーベイランス調査では、輸入鶏肉からVanA型VREが検出されている。
2009年から2015年に都内流通食肉における原産国別のVRE検出状況を表1に示した。VanA型VREは、国産鶏肉353検体中1検体(0.3%)、輸入鶏肉251検体中9検体(3.6%)より検出され、菌種は Enterococcus faecium(8株)、E. durans(1株)、E. faecalis(1株)であった。分離されたVanA型VRE10株のうち、9株はブラジル産鶏肉由来であった。日本の輸入鶏肉を国別にみると、ブラジル産が重量換算で約80%を占めており、今回の検査対象輸入鶏肉もその割合に準じた。なお、2010年から2012年には鶏肉に加え、牛肉162検体と豚肉107検体についても調査を行ったが、牛肉や豚肉からは、VanA型VREは検出されなかった1)。また、VanB型VREは、東京都で実施した食肉検査では検出されていない。
VanA型VRE 10株についてMIC測定を行った結果、VCMのMIC値は、>256 μg/mlが8株、16 μg/mlが1株、12 μg/mlが1株であった(表2)。テイコプラニン(TEIC)においては、32 μg/mlが1株、16 μg/mlが1株、<16 μg/mlが8株であり、2009年から2014年に鶏肉から分離されたVanA型VRE10株のうち8株がTEIC感受性株であった。従来、ヒトから分離されたVanA型VREはVCM耐性、TEIC耐性と報告されてきたが、近年、欧州やアジアでVanA型VREのTEIC感受性株が報告されている。これらTEIC感受性株は、vanAの調節遺伝子であるvanSの変異によるものとの報告がある2)。
3.βラクタマーゼ産生大腸菌
βラクタマーゼは、ペニシリンなどのβラクタム環を持つ抗生物質を分解する酵素である。これまでに、多くのβラクタム系抗菌薬が開発されてきた一方、それらの薬剤に対する耐性菌が出現してきた。現在、医療現場では、第三世代セファロスポリン系薬剤が広く使用されている。基質特異性拡張型βラクタマーゼ(extended-spectrum β-lactamase)(ESBL)やAmpC型βラクタマーゼ(AmpC)は、それらの薬剤を分解することから、ESBLやAmpC産生菌は、第三世セファロスポリン系薬剤に対して耐性となる。また、βラクタマーゼ産生遺伝子がプラスミド上に存在する場合には、同種間および腸内細菌科の異なる菌種間に伝達される可能性があり、その拡散が危惧される。
2015年に都内で流通した食肉から分離された大腸菌の薬剤感受性試験を行い、ESBLおよびAmpC産生大腸菌の分布状況を調査した。
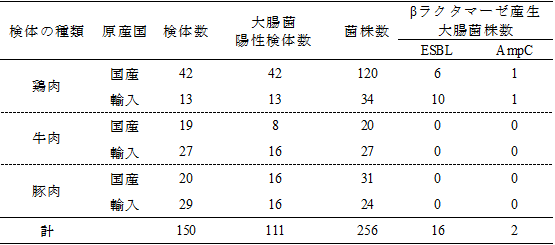
鶏肉55検体(国産42検体、輸入13検体)、牛肉46検体(国産19検体、輸入27検体)、豚肉49検体(国産20検体、輸入29検体)について調査を行ったところ、鶏肉55検体、牛肉24検体(国産8検体、輸入16検体)、豚肉32検体(国産16検体、輸入16検体)から、計256株の大腸菌が分離された(表3)。
分離された大腸菌株について薬剤感受性試験を行った結果、ESBL産生大腸菌が国産鶏肉6検体から6株、輸入鶏肉(ブラジル産)7検体から10株、AmpC産生大腸菌が国産鶏肉1検体から1株、輸入鶏肉(ブラジル産)1検体から1株分離された。分離されたβラクタマーゼ産生菌18株について、ベロ毒素、易熱性エンテロトキシン、耐熱性エンテロトキシンの遺伝子の有無を確認したところ、すべて陰性であった。しかし、βラクタマーゼ産生遺伝子がプラスミ上に存在する場合は、下痢原性大腸菌にも伝播する可能性があることから、今後も動向に注視していく必要がある。
以上の結果から、都内流通鶏肉にVREやβラクタマーゼ産生大腸菌が存在することが確認された。これらの菌は適切な加熱処理により死滅するため、食肉は十分に加熱して喫食することや、食肉により食品の製造、調理環境を汚染しないよう取扱いに注意することが重要と考えられる。
参考文献
1) 西野由香里ら:日食微誌,33, 76-81,2016.
2) Hashimoto,Y. et al. :FEMS Microbiol. Lett., 185,247-254. 2000.
(食品微生物研究科 西野由香里)
表1. VanA型VREの検出率(2009年~2015年)
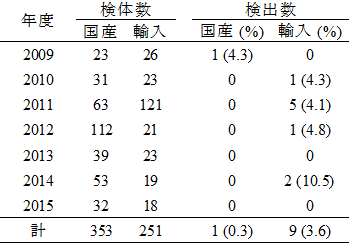
表2. VanA型VREのVCMおよびTEICに対するMIC
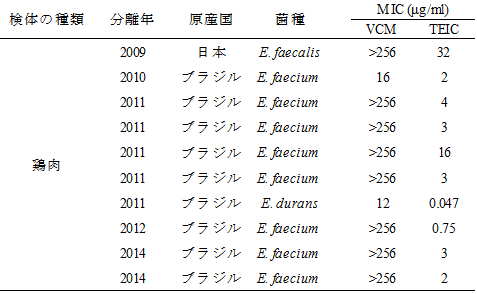
表3. 食肉におけるβラクタマーゼ産生大腸菌の検出数(2015年)