1981年、世界で初めて後天性免疫不全症候群(AIDS)の患者が報告され、1983年にはAIDS患者からフランスのパスツール研究所のリュック・モンタニエらがヒト免疫不全ウイルス(HIV:報告論文ではLAV)を分離した。1985年には米国FDAで検査試薬が承認され、その後、全世界でHIV検査ができるようになった。
日本においては、1985年に最初のエイズ患者が報告され、1987年には神戸で日本初の女性のエイズ患者が報告されたことから、エイズパニックとして社会的な問題となった。その後、全国で保健所を中心とするHIV検査体制が構築されることとなり、1987年から地方衛生研究所におけるHIVスクリーニング検査及び確認検査を実施する体制が整備されることとなった。
当時のスクリーニング検査試薬は、第1世代のスクリーニング検査試薬であり、現在の第4世代と比べ、試薬の種類も少なく、感度、特異性ともに劣っていた。HIV感染後の急性期には血中のウイルス抗原量が著しく増加し、その後HIVに対する抗体が出現するが、第1世代検査試薬では急性期の抗原検出や感染初期の抗体検出は困難であった。また、細胞で増殖させたウイルスを抗原としていたことから、細胞等に対する抗体が偽反応を起こすことがあり、偽陽性率も現在の試薬と比べ高かった。HIVにはHIV-1とHIV-2があり、我が国における感染者の多くはHIV-1によるものであるが、当時の試薬ではHIV-2の検出はできなかった。
その後、第2,3世代と様々な改良がなされ、現在では、HIV-1とHIV-2の抗体はもちろんのこと、HIV-1の抗原も同時に検出が可能な第4世代のスクリーニング検査試薬が多くの会社から発売されている。また、イムノクロマト(IC)法を原理とするスクリーニング検査試薬も販売され、数十分で結果が得られることから、保健所等においては即日検査で使用されている。
一方、確認検査としては、1987年当時からウエスタンブロット(WB)法や間接蛍光抗体(IF)法はあったが、IF法はHIV-1にのみの対応であったため、早々に用いられなくなった。WB法は客観性においてIF法より優れており、HIV-1と2の検査も可能であるが、第4世代スクリーニング検査試薬と比べると、感度、特異性の面で著しく劣っている。さらに、約3時間半程度の検査時間を要する点、HIV-1とHIV-2を別々に実施しなければならない点、結果判定が目視である点、偽反応が多い点(第1世代試薬と同じ原理であるため)等の問題点があり、検査の現場において結果の判定で苦慮するケースが生じていた。
特に、第4世代スクリーニング検査で陽性のうち、抗原量が多い場合はWB法で陰性となり、抗体量が少ない場合にはWB法で判定保留となる。そのような場合には遺伝子検査法を行わなければならない。現在のHIV感染症診断においては1)、WB法を補完する形で確認検査としてWB法と遺伝子検査法を同時に実施することとしている(2008年日本エイズ学会・日本臨床検査医学会標準推奨法)(図1)。
厚生労働科学研究班の報告では、衛生研究所を対象にHIV精度管理を実施したところ、参加施設間でWB法の判定に差を生じていた2)。HIV-1とHIV-2のWB法では相互に交差性があり、どちらかが陽性の場合にはどちらかが判定保留となることが多いが、この現象が一部の施設では理解されていなかった。各施設ではWB法は検査試薬添付の説明書に準じて実施されているが、HIV確認検査の経験が浅いと、添付説明書だけでは最終判定が難しい場合がある。
2018年11月、新たなHIV確認検査試薬(Geenius HIV1/2キット)が我が国で承認された3)。この試薬は、1回の検査でHIV-1とHIV-2の感染の有無、診断が可能である(HIV-1/HIV-2抗体識別検査)。また、IC法の原理を用いていることから、WB法と比べ、検査時間が30分程度と大幅に短い。さらに、機器を用いた結果判定が可能なため、WB法のように判定に苦慮すること、施設間で結果に差が生じることはない。
既に報告されている論文4)では、感染初期検体でWB法により判定保留であった13例中7例が陽性(6例は判定保留)と高感度であり、陰性血清を用いた特異性では98.5%とWB法(HIV-1 81.5%、HIV-2 90.0%)と比べて高く、非特異反応も少ないことから、WB法より多くの点で優れているとされる。
米国CDCではHIV検査のアルゴリズムが2014年に提示されているが(図2)5)、この中にWB法は存在しない。すなわち、第4世代スクリーニング検査で陽性の場合、HIV-1/HIV-2抗体識別検査で確認検査を行うこととしている。HIV-1とHIV-2について、陽性か否かを判定し、判定保留もしくは陰性の場合は、HIV-1の遺伝子増幅(NAT)検査を行う事としており(図2)、かなりシンプルなアルゴリズムとなっている。
日本におけるHIV検査のガイドラインとしては、エイズ学会推奨法1)や国立感染症研究所の病原体検査マニュアル6)等が知られている。その中では常にWB法が確認検査の中心であったが、今後はHIV-1/HIV-2抗体識別検査が中心となり、HIV診断の流れが一気に米国に追いつく機会となる。本試薬の登場により、我が国のHIVガイドラインの改訂が順次なされていくと思われる。
2014年に国連合同エイズ計画(UNAIDS)は、2020年までのHIV流行を制御する戦略として「90-90-90」の目標を掲げた。すなわち、感染者の90%以上が診断を受け感染を自覚し、診断を受けた感染者の90%以上が治療を受け、治療中の患者の90%以上で血中ウイルス量の抑制を目指すものである。また、近年は「U=U(Undetectable = Untransmittable)」キャンペーンが広がっている。HIV治療薬の服薬継続中で血液中のウイルスが検出限界未満を継続している場合には、パートナーにHIVを感染させるリスクは非常に少ないというものである。
このことからも、HIVの排除・撲滅も夢物語ではなくなってきたといえる。我々、衛生研究所の使命としては確実なHIV検査で正確に陽性を検出することであり、陽性者を着実に医療機関での治療へとつなげていくことである。迅速、高感度並びに特異度の高い確認検査法の登場は、保健所等での無料匿名検査をベースとしたエイズ対策のさらなる前進を期待させる。
1) 山本 直樹ら:日本エイズ学会誌,11, 70-72, 2009
2) 貞升健志ら:厚生労働科学研究,エイズ対策政策研究事業,HIV検査受検勧奨に関する研究班,平成29年度総括・分担研究報告書,198-204, 2018
3) The Medical & Test Journal, N.1450, 2019/1/1
4) Kondo, M. et al. : PLoS One, 13, e0198924, 2018
5) Laboratory testing for the diagnosis of HIV infection : updated recommendations
https://stacks.cdc.gov/view/cdc/23447,CDC,2014
6) 病原体検出マニュアル:後天性免疫不全症候群(エイズ)/HIV感染症(2018年10月版)
http://www.niid.go.jp/niid/images/lab-manual/HIV20181031.pdf
(微生物部 貞升健志)
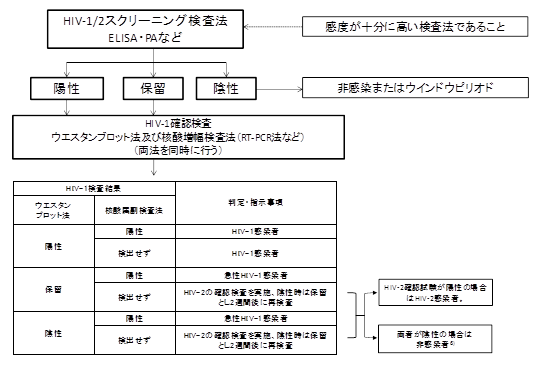
図1. 診療におけるHIV-1/2感染症診断のためのフローチャート
HIV-1/2感染症の診断法 2008年版
(日本エイズ学会・日本臨床検査医学会 標準推奨法)
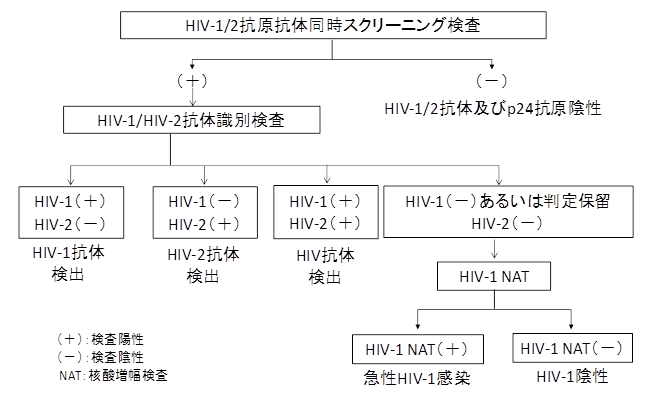
図2.HIV検査診断のアルゴリズム(CDC、2014年5) )
